114年01月03日修訂
一、目的:
為確保本院病人使用安全有效之藥品,期能妥善管理藥品使用狀況,避免藥事資源浪費。
二、定義:
凡具有衛生福利部藥品許可證之藥品,並符合下列任一項規範:
- 與本院現有藥品之成分、含量、劑型不同。
- 臨床治療效果優於現有藥物,或低於現有藥品之不良反應,且具有文獻資料佐證。
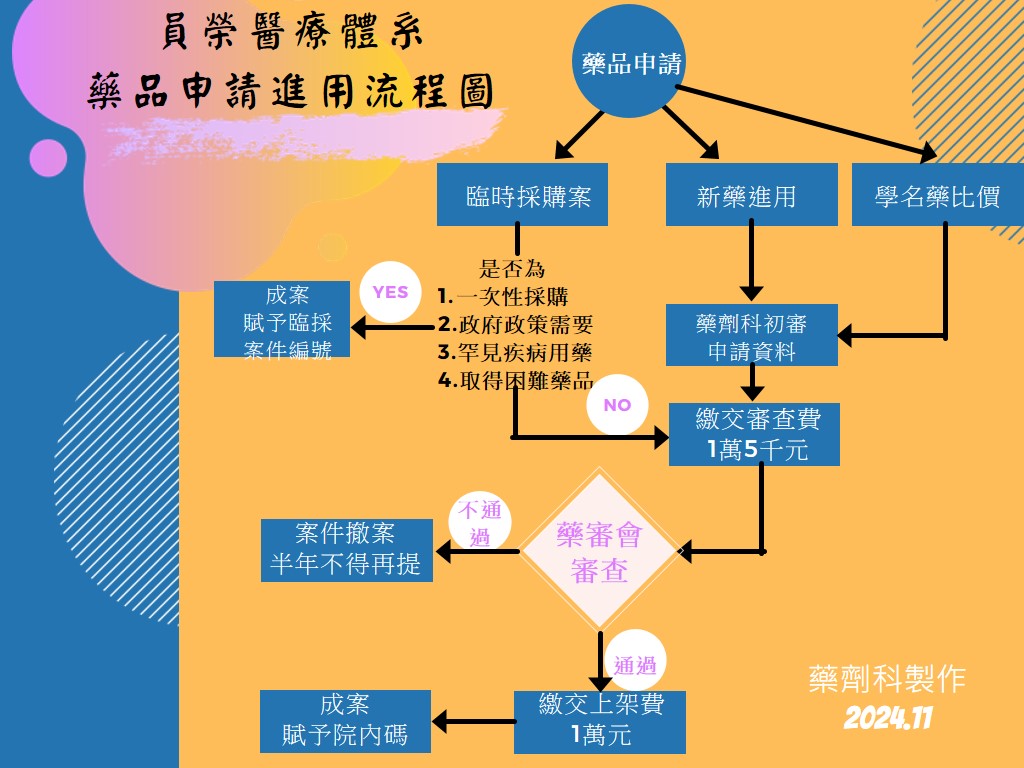
三、申請辦法:
- 申請人:限本院主治醫師。
- 申請時間:每季第一個月底以前提出(1/31、4/30、7/31、10/31前)。
- 申請費用:申請資料送藥劑科審查無誤後,每案需繳交新藥申請審查費壹萬伍仟元至櫃檯(臨時採購追認案已繳費者,可免繳),收據證明需送藥劑科存檔。本院收件後即開始新藥審查作業,若廠商或醫師撤回申請案,或因繳交文件不齊全,致無法完成審核,均不予退費,敬請審慎考慮。
4. 檢附資料(一份):
(1)新藥申請表 紙本及電子檔 。 申請醫師填寫
(2)新進藥品資料表 紙本及電子檔 。 廠商代表填寫 範例:新藥資料表填寫範例
(3)中文或英文仿單。
(4)藥品許可證,或該藥產地國之相關衛生主管機關證明文件。
(5) 國內 至少 兩家醫學中心採購證明。
(6)代表性文獻至 少一篇。
(7) 新藥 Micromedex 相關資料、 BA/BE 試驗證明報告及通過 BA/BE 試驗批次藥品品質相關資料 。
(8) PIC /S GMP 證明文件。
(9) 藥品外觀相片檔。
(10) 原廠授權書(非許可證之申請商)。
(11) 藥品審費用收據。
四、申請程序
1.送件:
由申請醫師或藥廠代表,依規定時間將檢附資料送交藥劑科,逾時視同放棄本次申請案。
2.藥劑科初審:
新藥申請檢視,送藥事委員會開會前15日完成。
3.採購室議價:初審完成,由藥劑科通知廠商至採購室辦理議價,完成議價程序後,移至藥事委員會審核。
4.藥事委員會審核:
符合初審之新藥案,於每年三、六、九、十二月最後一周提交藥事委員會開會審核。申請醫師未出席或未委託代理列席說明時,視同棄權該次申請案。
五、管理規定
1. 藥事委員會決議藥事委員會決議
(1)不同意案:一年內不得再提出相同藥品類似物交付討論。
(2)同意案:自院內公告日算起,移請採購室通知廠商,兩星期內完成議價。
由藥劑科完成建檔、公告、上架作業。未完成議價者視同放棄本次申請,一年內並不得再提出相同藥品申請。
2.近半年無或少於近半年無或少於33次使用紀錄之院內藥品,提報藥事委員會決議刪除。
六、藥品進用後評估:
1.每半年列表追蹤新進藥品使用狀況。
2.藥事委員會決議刪除或廠商供貨不良之藥品,一年內不得再提出申請。
七、其他:
凡衛生主管機關要求藥品下架回收,或藥廠延遲、缺貨等緊急狀況……等無法正常提供供貨,且院內無類似成分時,由藥劑科提供兩~三家廠商,請採購部門詢價後,會簽主任委員,經院長同意後擇一按臨時採購藥品規範辦理。
八、附則:
本辦法呈總院長核准後公告實施,修正時亦同。
附件:新進藥品管理辦法